Atomární uhlík
| Atomární uhlík | |
|---|---|
| Systematický název | methandiyliden |
| Ostatní názvy | λ0-methan |
| Sumární vzorec | C |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 7440-44-0 |
| PubChem | 5462310 |
| ChEBI | 27594 |
| SMILES | [C] |
| InChI | InChI=1S/C |
| Vlastnosti | |
| Molární hmotnost | 12,011 g/mol |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
Některá data mohou pocházet z datové položky. | |
Atomární uhlík, systematickým názvem λ0-methan nebo methandiyliden je bezbarvá anorganická plynná látka se vzorcem C. Za standardních podmínek je kineticky nestabilní a podléhá autopolymerizaci. Lze jej považovat za monomer grafitu.
Vlastnosti
[editovat | editovat zdroj]Amfoterita
[editovat | editovat zdroj]Atomární uhlík může reagovat s Lewisovou kyselinou, která se může spojit s elektronovým párem uhlíku, také může elektronový pár Lewisovy kyseliny reagovat s uhlíkem:
[2]::[C] + M → [MC]
- [C] + :L → [CL]
Vzhledem k této schopnosti přijímat či odevzdávat elektrony je atomární uhlík Lewisova amfoterní látka.[3]
Atomový uhlík může Lewisovým kyselinám dodat či od nich převzít až dva elektronové páry. Může být též protonován:
- C + H+ → CH+
Tento záchyt protonu znamená, že je atomární uhlík též Brønstedova–Lowryho zásada. Jeho konjugovanou kyselinou je λ2-methylium (CH+).
Vodné roztoky aduktů jsou ovšem nestabilní, jelikož dochází k hydrataci uhlíkového centra a λ2-methyliové skupiny za vzniku λ2-methanolu (CHOH), λ2-methanu (CH2) nebo hydroxymethyliové skupiny (CH2OH+). λ2-methanolová skupina se může polymerizovat na formaldehyd, či se dále hydratovat na dihydroxymethylium (CH(OH) +
2 a nebo reagovat s vodou na formylium (HCO+).[2]
Elektromagnetické vlastnosti
[editovat | editovat zdroj]Elektrony jsou v atomovém uhlíku rozděleny podle výstavbového principu, čím vznikají různé kvantové stavy, každý s jinou energetickou úrovní. Nejnižší energii má základní stav, což je tripletový diradikálový stav (3P0). První dva excitované stavy mají poměrně podobné energie, jde o singletový (1D2) a singletový diradikálový (1S0) stav. Neradikálová forma atomárního uhlíku se nazývá λ2-methyliden, diradikálový stav má systematický název λ2-methandiyl.
Stavy 1D2 a 1S0 mají energii oproti základnímu stavu vyšší o 121,9 a 259,0 kJ mol−1. K přechodům mezi těmito stavy obvykle nedochází, protože je k tomu nutná změna spinu nebo spárování elektronů, což vede k fosforescenci na vlnové délce 981,1 nm, tedy v blízké infračervené oblasti. Po excitaci ultrafialovým zářením může také dojít k fluorescenci na 873,0 nm, tedy v infračerveném záření, a k fosforescenci na 461,9 nm (v modrém světle).
Příprava
[editovat | editovat zdroj]Atomární uhlík se připravuje průchodem velkého elektrického proudu mezi dvěma uhlíkovými tyčemi, čímž se vytvoří elektrický oblouk. Způsob přípravy této látky je podobný přípravě fullerenu C60, rozdíl spočívá hlavně v použití mnohem tvrdšího vakua. Samotný atomární uhlík vzniká termolýzou 1H-tetrazol-5-aminu, přičemž se odštěpují 3 ekvivalenty molekulárního dusíku:[4]
CN6 → :C: + 3N2
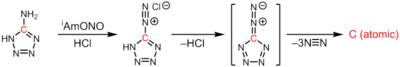
Zdrojem atomárního uhlíku může být také rozklad karbidu tantalu.[5] Při tomto procesu se nejprve vloží uhlík do tenkostěnné nádoby z tantalu. Po uzavření této nádoby dochází k zahřívání stejnosměrným elektrickým proudem. Solvatované atomy uhlíku difundují k vnějšímu povrchu nádoby a po dosažení určité teploty se z povrchu nádoby začne odpařovat atomární uhlík. Tímto postupem vznikají atomy uhlíku bez příměsí dalších látek.
Dekarbonylace suboxidu uhlíku
[editovat | editovat zdroj]Další možnou metodou přípravy atomárního uhlíku je dekarbonylace suboxidu uhlíku. Při tomto postupu se suboxid uhlíku rozkládá na atomový uhlík a oxid uhelnatý podle následující rovnice:
- C3O2 → 2 CO + [C]
Při tomto postupu se vytváří meziprodukt, kterým je monoxid diuhlíku, reakce probíhá ve dvou krocích, přičemž je u každého potřeba ozářit reakční směs tvrdým ultrafialovým zářením.
- OCCCO → [CCO] + CO
- [CCO] → CO + [C]
Reakce
[editovat | editovat zdroj]Protože je atomární uhlík látkou s nedostatkem elektronů, tak podléhá samovolné polymerizaci a také vytváří adukty s Lewisovými kyselinami a zásadami. Oxidací z něj vzniká oxid uhelnatý, redukcí λ2-methan. Nekovy, jako je kyslík, s atomárním uhlíkem reagují za vzniku sloučenin s dvojvazným uhlíkem:
2 [C] + O2 → 2 CO
Atomární uhlík je velmi reaktivní, většina jeho reakcí je značně exotermní. Většinou se provádějí v plynné fázi za teploty kapalného dusíku (77 K). Příklady takových reakcí jsou:[6]
- Připojení na vazbu C-H v alkanech za vzniku karbenů.
- Deoxygenace karbonylových sloučenin za vzniku karbenů, například z butanonu vzniká butan-2-yliden.
- Připojení na dvojnou vazbu mezi uhlíky za vzniku cyklopropylidenu, u něhož dochází k otevírání cyklu, z alkenů se takto tvoří kumuleny.
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Atomic carbon na anglické Wikipedii.
- ↑ a b Methane. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ a b D. Husain; L. J. Kirsch. Reactions of Atomic Carbon C(23PJ) by Kinetic Absorption Spectroscopy in the Vacuum Ultra-Violet. Transactions of the Faraday Society. 1971, s. 2025–2035. DOI 10.1039/TF9716702025.
- ↑ Catherine E. Housecroft; Alan G. Sharpe. Inorganic Chemistry. [s.l.]: Pearson Education, Ltd., 2012. (4). ISBN 978-0-273-74275-3. Kapitola Acids, bases and ions in aqueous solution, s. 227.
- ↑ Philip B. Shevlin. Formation of atomic carbon in the decomposition of 5-tetrazolyldiazonium chloride. Journal of the American Chemical Society. 1. 5. 2002, s. 1379–1380.
- ↑ S. A. Krasnokutski; F. Huisken. A simple and clean source of low-energy atomic carbon. Applied Physics Letters. 15. 9. 2014, s. 113506. Bibcode 2014ApPhL.105k3506K.
- ↑ Reactive Intermediate Chemistry, Robert A. Moss, Matthew S. Platz and Maitland Jones Jr., Wiley-Blackwell, (2004), ISBN 978-0471233244

